P
pilou12
Guest
Sin pisar la calle hasta los 5 años: la historia de Yago, el 'niño burbuja' del Hospital 12 de Octubre
Historias
NOTICIA

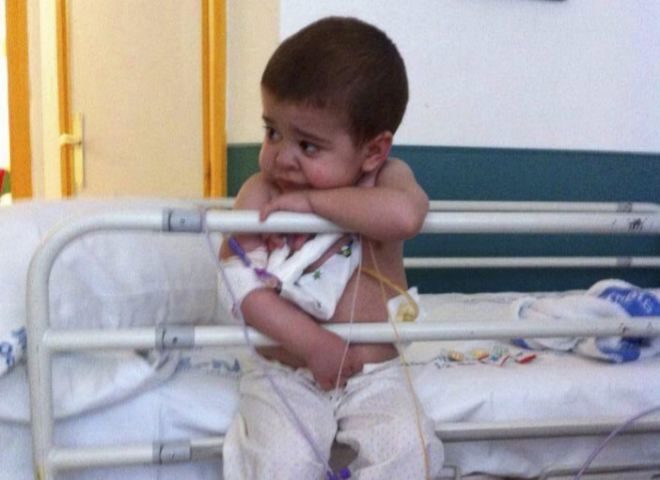
Yago, siete años, posando en la escalera de su casa. REPORTAJE GRÁFICO: ÁNGEL NAVARRETE
Fue hospitalizado a los seis meses de nacer en Oncología infantil con un extraño tipo de cáncer. Estuvo cinco años ingresado sin salir al exterior y dos de ellos en aislamiento. Para conocer a su hermano, tenía que utilizar Skype
Cuando se curó y pudo pisar de un modo consciente el mundo exterior por primera vez, ya había pasado un lustro: jamás había visto una hormiga o se había mojado bajo la lluvia. Esta es la historia de un bebé que vino al mundo con cinco años
A los siete meses de nacer fue ingresado en Oncología Infantil sin plano de salida. Estuvo dos años y medio en aislamiento. El niño creció asomándose al mundo sólo desde la ventana de la habitación 704, un espacio que era como un submarino: no se podía salir fuera.
Allí en la planta séptima no sabía lo que era la nieve ni cómo iba una bici. No había tocado una mascota ni subido a un columpio. Van a entenderlo mejor del siguiente modo: para hablar y jugar con su hermano, se conectaba por Skype.
La Humanidad recuerda el paso iniciático de Armstrong en la Luna y la madre de Yago se acuerda del primero que dio su hijo en el exterior. Ahí va. Un paso al aire libre. Otro más. El chaval acaba de cumplir cinco años y parece un astronauta. Pero por dentro es un bebé que acaba de venir al mundo.
Podría ser un experimento sociológico llevado al extremo, pero es una historia real.
Así que no se extrañen de los momentos que vienen, como si encendiéramos un viejo Cinexin y fueran saliendo estas escenas que grabó la madre.
Yago y los insectos.
«Tenía casi seis años cuando vio por primera vez una mosca. Gritó de miedo. Al poco tiempo descubrió también las hormigas. '¿Por qué van en fila, mamá?'».
Yago y la lluvia.
«Era de las primeras veces que podía estar fuera. Empezó a llover. Yo le dije que corriéramos para el hospital, porque nos íbamos a mojar. Él se quedó muy quieto mirando al cielo: '¡¡Mamá, la lluvia está fría!!'. 'Sí, hijo'. '¡¡Y de los charcos salen pompas!!'».
Yago y la lavadora.
«Cuando por fin llegamos a casa, se ponía a abrir los cajones como hacen los bebés. Con cualquier cosa que cogía, una batidora, un cascanueces, preguntaba: '¿Y esto para qué vale?'. Lo que más le llamó la atención fue la lavadora. Nunca había visto una. Cuando centrifuga, todavía hoy viene a verlo».
Yago y el sol.
«El primer día de su vida que salió al exterior con su palo porta-suero con ruedas, dio cuatro pasos y se quedó parado. Había cumplido los cinco. Le dije: 'Anda. ¿Qué te pasa que no andas?'. Me contestó: '¡Mamá, yo también tengo sombra!'. Le dije: 'Claro, todos tenemos sombra, hijo'. Me respondió: 'No, yo antes no tenía sombra'».

MI HIJO HA VIVIDO EN UNA BURBUJA DESDE QUE NACIÓ. CUANDO SALIÓ AL EXTERIOR CON CINCO AÑOS ERA COMO UN BEBÉ. SÓLO QUE LOS BEBÉS NO PUEDEN EXPLICARSE Y ÉL SÍ
María Jesús Quiroga, madre de Yago
Hay muchas biografías asombrosas en la planta de Oncología Infantil del Hospital 12 de Octubre, pero ninguna como la de este insólito chico burbuja.
Tiene siete años, la estructura ósea de un niño de cuatro [fruto de la alimentación parenteral], pesa 18 kilos y no llega al metro, se tira 11 horas al día conectado a una máquina para medicarse y nutrirse y sufre un tipo de cáncer denominado histiocitotis sistémica de células de Langerhans. Es el nombre de la enfermedad rara que lo encerró con siete meses en una séptima planta, se tragó la llave y no lo dejó salir hasta mediada la infancia.
«Mi hijo ha vivido en una burbuja para salvar la vida: desde que nació, estuvo periodos muy largos con la ventana sellada y la puerta cerrada, sin visitas...», cuenta su madre, María Jesús Quiroga. «La primera vez que pisó el mundo exterior fue en un parque infantil que acababa de construir la Fundación Juegaterapia en el hospital para estos niños. Todo era nuevo para él. Era como un bebé. Lo que pasa es que los bebés no pueden explicarse y él sí podía».
Hay un dato que explica muy bien las recaídas y resurrecciones de Yago Frías: el niño ha aprendido a andar cuatro veces.
En cinco años confinado, ha pasado 30 veces por quirófano, ha ingresado siete veces en la UCI, ha estado a punto de morir en diversas ocasiones, se ha tirado largos periodos sedado con morfina de la que apenas despertaba 15 minutos al día, épocas en las que recibía transfusiones de sangre a diario.
Pero había una ventana.
Una tarde. A su madre. En Oncología. Mientras veía llover sin saber que la lluvia estaba fría: «Mamá, me estoy quedando sin amigos».
EL INGRESO
«Aparentemente estaba sano. Pero yo notaba que al bebé le pasaba algo, aunque no supiera el qué», prueba el café María Jesús Quiroga, huele a chimenea en Torrejón de Velasco (Madrid). «En la revisión de los seis meses, su pediatra le vio unos lunares rojos en el abdomen y le derivó al dermatólogo. Allí vieron algo extraño porque cogieron una muestra de los lunares y esa misma tarde me llamaron del Hospital Infanta Cristina de Parla para que fuera».
Escuchó la palabra «histiocitosis» por primera vez. También por primera vez escuchó «enfermedad muy rara». Y «tratamiento». Y «mucho ánimo». Escuchó por primera vez un montón de cosas que luego escucharía decenas de veces.
«Entonces, cuando me recompuse, le pregunté que cuántos casos como el de Yago conocía él. Aquel doctor tendría unos 60 años. Me contestó que uno solo. De su etapa de residente. Le volví a preguntar: que cómo estaba ese paciente. El doctor me cambió de tema».
En esta historia no hay muchos márgenes de maniobra. Ni hermosos paisajes de fondo con el protagonista delante. Ni ningún viaje de verano. En esta historia tampoco hay un padre presente. Sólo una madre que ocupa el doble de espacio. Para cuidar de Yago dejó su puesto de contable y encomendó la crianza del mayor, Javier (cuatro años cuando ingresaron a Yago y 11 hoy), a sus abuelos. En esta historia no hay tiempo que perder.

LA HISTORIA DE YAGO NO ES NORMAL. LOS NIÑOS ENTRAN Y SALEN DE ONCOLOGÍA O PERMANECEN UNOS MESES AQUÍ. PERO NO TANTOS AÑOS. EL HOSPITAL HA SIDO SU CASA
Vanesa Pérez, oncóloga del Hospital 12 de Octubre
En otoño de 2011 es derivado al Hospital 12 de Octubre. La quimioterapia no funciona. La enfermedad avanza. El niño ya tiene afectaciones medulares, hematológicas, de piel y de mucosas, en huesos como el cráneo y la tibia.
«Empezó a decaer, irascible, dejó de comer, tenía heridas en la boca por las que sangraba y que había que quemar con nitrato de plata, le ponían sangre a diario. Todo eso con poco más de un año. Hasta que un día, en el hospital, me entró el pánico cuando me dijeron aquello: 'Ya no sabemos qué hacer'».
Pero la madre sí sabía.
Por entonces lo único que funcionaba era el sonido del camión de bomberos. Cuenta que para sacarle del letargo, le levantaba conectado a sus cables y lo acercaba a la ventana para que se asomara a verlos pasar. «Aquello le iluminaba la cara», dice. María Jesús llegó a descargarse el sonido de la sirena en el móvil. Lo ponía a modo de resorte. Y le engañaba para que hiciera por moverse: «¡Vamos corriendo, Yago! ¿Oyes? ¡Son los bomberos!».
LOS OTROS
El niño enfermo tardó un lustro en dar su primer paso ahí fuera y en este reportaje ya van más de 1.000 palabras escritas. Así que ya va siendo hora de las buenas noticias.
La primera es que el tratamiento recomendado por un especialista del Boston Children's Hospital (el español Carlos Rodríguez-Galindo) salió bien.
La segunda nos la desgrana Elena Morán, psicóloga de Juegaterapia especialista en neurodesarrollo, quien trató a la familia entera. «Para Yago todo fue un aprendizaje: cómo se echaba gasolina, cómo era un supermercado, los pasos de cebra... Tiene una inteligencia emocional brutal, es listísimo, va sobrado de autoestima y muestra una madurez muy grande, dado que se ha criado entre adultos. A Javier, como les pasa a muchos hermanos de enfermos, le ocurre al revés: se hacen pequeños, se sienten culpables por haber estado sanos. Y luego está esta madre, que tiene una energía fuera de serie y nunca ve lo negativo. Porque remontar esto sola no es nada fácil».
La tercera buena noticia es que, desde finales de 2016, María Jesús pudo llevarse a Yago a casa.
La cuarta es que el año pasado logró incorporarse con normalidad al Colegio El Catón en el último trimestre; que el niño con altas capacidades en pensamiento lógico y vocabulario -según el equipo de valoración de la Comunidad de Madrid- acabó con un 9,3 en Matemáticas; y que estamos en 2º de Primaria estudiando los insectos.
«Imagina. Ha pasado de estar en aislamiento a una clase con 26 niños. Todo le llama la atención. Se ha echado de mejores amigos a los dos más altos de clase, Miguel Ángel y Leandro, que le llevan la cartera. Y viene a casa alucinando», se ríe la madre. «Me dice: '¡Mamá!, no te lo vas a creer... No escuchan'. Es como un viejito».

MI HIJO ME HA ENSEÑADO A PELEAR, COMO CUANDO NO SABÍAMOS QUÉ HACER Y ME MIRABA CON ESOS OJOS DESDE LA CAMA DE LAS 704 Y ME DECÍA QUE NO ME RINDIERA
Hay una quinta buena noticia, y una sexta, y una séptima, y en fin.
Habla Vanesa Pérez, oncóloga de la unidad que le ha tratado en el 12 de Octubre: «La historia de Yago no es normal. Los niños entran y salen de Oncología o permanecen unos meses aquí. Pero no tantos años. El hospital ha sido como su casa y toda esta gente ha sido su familia».
En esta vivienda de Torrejón de Velasco que parece un hospital de campaña, la ex contable María Jesús se capacitó como enfermera coyuntural y ella misma se ocupa de la medicación. El niño sigue con su histiocitotis sistémica de células de Langerhans, pero está controlado y estable. Se pasa 11 horas al día conectado a una máquina. Cada 15 días va al hospital para que controlen sus niveles. Cada tres meses es sometido a una reevaluación. Y Yago ya corre sin necesidad de escuchar una sirena.
LA LUZ
La foto que tiene en la habitación recuerda un poco a una orla y también a aquella otra fotografía ochentera del equipo de futbito Dejadnos Vivir de Vilanova de Arousa. Una imagen en la que siete de los 10 jóvenes que posan en pantalones cortos acabaron muriendo por la heroína.
La instantánea evoca aquello, decimos, sólo que en el sentido contrario: de los 41 niños oncológicos que aparecen en la foto (Yago incluido), la mitad está sana y salva.
«Mi hijo me ha enseñado a pelear, como cuando no sabíamos qué hacer y me miraba con esos ojos desde la cama de la 704 y me decía que no me rindiera; me ha enseñado a ser feliz con el simple hecho de ir a recogerlo al cole o estar comiendo pipas en un banco mirándole a él».

LLEGÓ A CASA EXTRAÑADO TRAS EL SEGUNDO DÍA DE CLASE. ME PREGUNTÓ: 'MAMÁ, ¿DÓNDE ESTÁN LOS NIÑOS SIN PELO Y EN SILLA DE RUEDAS?
María Jesús Quiroga, madre de Yago
La lluvia está fría, chaval.
Las hormigas siempre van en fila, ya sabes.
Las moscas no se comen a nadie, eh.
Los niños pueden tener melena.
Y todos, sin excepción, tienen una sombra.
Por eso, al poco de incorporarse al colegio, Yago se acordó de los que cada día pelean para no quedarse sin ella.
«Llegó a casa, era el segundo día que iba a clase, se me acercó extrañado y me hizo una pregunta que no se me olvidará: 'Mamá, ¿dónde están los niños sin pelo y en silla de ruedas?'».
Lo cuenta su madre mientras mira a los hijos.
Cómo escucha el mayor.
Y cómo corre el pequeño de contento a ver centrifugar la lavadora.
https://www.elmundo.es/papel/historias/2018/12/10/5c06c86ffdddff2f6d8b45c5.html
Historias
NOTICIA
- PEDRO SIMÓN
- Torrejón de Velasco (Madrid)
- 10 DIC. 2018

Yago, siete años, posando en la escalera de su casa. REPORTAJE GRÁFICO: ÁNGEL NAVARRETE
Fue hospitalizado a los seis meses de nacer en Oncología infantil con un extraño tipo de cáncer. Estuvo cinco años ingresado sin salir al exterior y dos de ellos en aislamiento. Para conocer a su hermano, tenía que utilizar Skype
Cuando se curó y pudo pisar de un modo consciente el mundo exterior por primera vez, ya había pasado un lustro: jamás había visto una hormiga o se había mojado bajo la lluvia. Esta es la historia de un bebé que vino al mundo con cinco años
A los siete meses de nacer fue ingresado en Oncología Infantil sin plano de salida. Estuvo dos años y medio en aislamiento. El niño creció asomándose al mundo sólo desde la ventana de la habitación 704, un espacio que era como un submarino: no se podía salir fuera.
Allí en la planta séptima no sabía lo que era la nieve ni cómo iba una bici. No había tocado una mascota ni subido a un columpio. Van a entenderlo mejor del siguiente modo: para hablar y jugar con su hermano, se conectaba por Skype.
La Humanidad recuerda el paso iniciático de Armstrong en la Luna y la madre de Yago se acuerda del primero que dio su hijo en el exterior. Ahí va. Un paso al aire libre. Otro más. El chaval acaba de cumplir cinco años y parece un astronauta. Pero por dentro es un bebé que acaba de venir al mundo.
Podría ser un experimento sociológico llevado al extremo, pero es una historia real.
Así que no se extrañen de los momentos que vienen, como si encendiéramos un viejo Cinexin y fueran saliendo estas escenas que grabó la madre.
Yago y los insectos.
«Tenía casi seis años cuando vio por primera vez una mosca. Gritó de miedo. Al poco tiempo descubrió también las hormigas. '¿Por qué van en fila, mamá?'».
Yago y la lluvia.
«Era de las primeras veces que podía estar fuera. Empezó a llover. Yo le dije que corriéramos para el hospital, porque nos íbamos a mojar. Él se quedó muy quieto mirando al cielo: '¡¡Mamá, la lluvia está fría!!'. 'Sí, hijo'. '¡¡Y de los charcos salen pompas!!'».
Yago y la lavadora.
«Cuando por fin llegamos a casa, se ponía a abrir los cajones como hacen los bebés. Con cualquier cosa que cogía, una batidora, un cascanueces, preguntaba: '¿Y esto para qué vale?'. Lo que más le llamó la atención fue la lavadora. Nunca había visto una. Cuando centrifuga, todavía hoy viene a verlo».
Yago y el sol.
«El primer día de su vida que salió al exterior con su palo porta-suero con ruedas, dio cuatro pasos y se quedó parado. Había cumplido los cinco. Le dije: 'Anda. ¿Qué te pasa que no andas?'. Me contestó: '¡Mamá, yo también tengo sombra!'. Le dije: 'Claro, todos tenemos sombra, hijo'. Me respondió: 'No, yo antes no tenía sombra'».
MI HIJO HA VIVIDO EN UNA BURBUJA DESDE QUE NACIÓ. CUANDO SALIÓ AL EXTERIOR CON CINCO AÑOS ERA COMO UN BEBÉ. SÓLO QUE LOS BEBÉS NO PUEDEN EXPLICARSE Y ÉL SÍ
María Jesús Quiroga, madre de Yago
Hay muchas biografías asombrosas en la planta de Oncología Infantil del Hospital 12 de Octubre, pero ninguna como la de este insólito chico burbuja.
Tiene siete años, la estructura ósea de un niño de cuatro [fruto de la alimentación parenteral], pesa 18 kilos y no llega al metro, se tira 11 horas al día conectado a una máquina para medicarse y nutrirse y sufre un tipo de cáncer denominado histiocitotis sistémica de células de Langerhans. Es el nombre de la enfermedad rara que lo encerró con siete meses en una séptima planta, se tragó la llave y no lo dejó salir hasta mediada la infancia.
«Mi hijo ha vivido en una burbuja para salvar la vida: desde que nació, estuvo periodos muy largos con la ventana sellada y la puerta cerrada, sin visitas...», cuenta su madre, María Jesús Quiroga. «La primera vez que pisó el mundo exterior fue en un parque infantil que acababa de construir la Fundación Juegaterapia en el hospital para estos niños. Todo era nuevo para él. Era como un bebé. Lo que pasa es que los bebés no pueden explicarse y él sí podía».
Hay un dato que explica muy bien las recaídas y resurrecciones de Yago Frías: el niño ha aprendido a andar cuatro veces.
En cinco años confinado, ha pasado 30 veces por quirófano, ha ingresado siete veces en la UCI, ha estado a punto de morir en diversas ocasiones, se ha tirado largos periodos sedado con morfina de la que apenas despertaba 15 minutos al día, épocas en las que recibía transfusiones de sangre a diario.
Pero había una ventana.
Una tarde. A su madre. En Oncología. Mientras veía llover sin saber que la lluvia estaba fría: «Mamá, me estoy quedando sin amigos».
EL INGRESO
«Aparentemente estaba sano. Pero yo notaba que al bebé le pasaba algo, aunque no supiera el qué», prueba el café María Jesús Quiroga, huele a chimenea en Torrejón de Velasco (Madrid). «En la revisión de los seis meses, su pediatra le vio unos lunares rojos en el abdomen y le derivó al dermatólogo. Allí vieron algo extraño porque cogieron una muestra de los lunares y esa misma tarde me llamaron del Hospital Infanta Cristina de Parla para que fuera».
Escuchó la palabra «histiocitosis» por primera vez. También por primera vez escuchó «enfermedad muy rara». Y «tratamiento». Y «mucho ánimo». Escuchó por primera vez un montón de cosas que luego escucharía decenas de veces.
«Entonces, cuando me recompuse, le pregunté que cuántos casos como el de Yago conocía él. Aquel doctor tendría unos 60 años. Me contestó que uno solo. De su etapa de residente. Le volví a preguntar: que cómo estaba ese paciente. El doctor me cambió de tema».
En esta historia no hay muchos márgenes de maniobra. Ni hermosos paisajes de fondo con el protagonista delante. Ni ningún viaje de verano. En esta historia tampoco hay un padre presente. Sólo una madre que ocupa el doble de espacio. Para cuidar de Yago dejó su puesto de contable y encomendó la crianza del mayor, Javier (cuatro años cuando ingresaron a Yago y 11 hoy), a sus abuelos. En esta historia no hay tiempo que perder.

LA HISTORIA DE YAGO NO ES NORMAL. LOS NIÑOS ENTRAN Y SALEN DE ONCOLOGÍA O PERMANECEN UNOS MESES AQUÍ. PERO NO TANTOS AÑOS. EL HOSPITAL HA SIDO SU CASA
Vanesa Pérez, oncóloga del Hospital 12 de Octubre
En otoño de 2011 es derivado al Hospital 12 de Octubre. La quimioterapia no funciona. La enfermedad avanza. El niño ya tiene afectaciones medulares, hematológicas, de piel y de mucosas, en huesos como el cráneo y la tibia.
«Empezó a decaer, irascible, dejó de comer, tenía heridas en la boca por las que sangraba y que había que quemar con nitrato de plata, le ponían sangre a diario. Todo eso con poco más de un año. Hasta que un día, en el hospital, me entró el pánico cuando me dijeron aquello: 'Ya no sabemos qué hacer'».
Pero la madre sí sabía.
Por entonces lo único que funcionaba era el sonido del camión de bomberos. Cuenta que para sacarle del letargo, le levantaba conectado a sus cables y lo acercaba a la ventana para que se asomara a verlos pasar. «Aquello le iluminaba la cara», dice. María Jesús llegó a descargarse el sonido de la sirena en el móvil. Lo ponía a modo de resorte. Y le engañaba para que hiciera por moverse: «¡Vamos corriendo, Yago! ¿Oyes? ¡Son los bomberos!».
LOS OTROS
El niño enfermo tardó un lustro en dar su primer paso ahí fuera y en este reportaje ya van más de 1.000 palabras escritas. Así que ya va siendo hora de las buenas noticias.
La primera es que el tratamiento recomendado por un especialista del Boston Children's Hospital (el español Carlos Rodríguez-Galindo) salió bien.
La segunda nos la desgrana Elena Morán, psicóloga de Juegaterapia especialista en neurodesarrollo, quien trató a la familia entera. «Para Yago todo fue un aprendizaje: cómo se echaba gasolina, cómo era un supermercado, los pasos de cebra... Tiene una inteligencia emocional brutal, es listísimo, va sobrado de autoestima y muestra una madurez muy grande, dado que se ha criado entre adultos. A Javier, como les pasa a muchos hermanos de enfermos, le ocurre al revés: se hacen pequeños, se sienten culpables por haber estado sanos. Y luego está esta madre, que tiene una energía fuera de serie y nunca ve lo negativo. Porque remontar esto sola no es nada fácil».
La tercera buena noticia es que, desde finales de 2016, María Jesús pudo llevarse a Yago a casa.
La cuarta es que el año pasado logró incorporarse con normalidad al Colegio El Catón en el último trimestre; que el niño con altas capacidades en pensamiento lógico y vocabulario -según el equipo de valoración de la Comunidad de Madrid- acabó con un 9,3 en Matemáticas; y que estamos en 2º de Primaria estudiando los insectos.
«Imagina. Ha pasado de estar en aislamiento a una clase con 26 niños. Todo le llama la atención. Se ha echado de mejores amigos a los dos más altos de clase, Miguel Ángel y Leandro, que le llevan la cartera. Y viene a casa alucinando», se ríe la madre. «Me dice: '¡Mamá!, no te lo vas a creer... No escuchan'. Es como un viejito».

MI HIJO ME HA ENSEÑADO A PELEAR, COMO CUANDO NO SABÍAMOS QUÉ HACER Y ME MIRABA CON ESOS OJOS DESDE LA CAMA DE LAS 704 Y ME DECÍA QUE NO ME RINDIERA
Hay una quinta buena noticia, y una sexta, y una séptima, y en fin.
Habla Vanesa Pérez, oncóloga de la unidad que le ha tratado en el 12 de Octubre: «La historia de Yago no es normal. Los niños entran y salen de Oncología o permanecen unos meses aquí. Pero no tantos años. El hospital ha sido como su casa y toda esta gente ha sido su familia».
En esta vivienda de Torrejón de Velasco que parece un hospital de campaña, la ex contable María Jesús se capacitó como enfermera coyuntural y ella misma se ocupa de la medicación. El niño sigue con su histiocitotis sistémica de células de Langerhans, pero está controlado y estable. Se pasa 11 horas al día conectado a una máquina. Cada 15 días va al hospital para que controlen sus niveles. Cada tres meses es sometido a una reevaluación. Y Yago ya corre sin necesidad de escuchar una sirena.
LA LUZ
La foto que tiene en la habitación recuerda un poco a una orla y también a aquella otra fotografía ochentera del equipo de futbito Dejadnos Vivir de Vilanova de Arousa. Una imagen en la que siete de los 10 jóvenes que posan en pantalones cortos acabaron muriendo por la heroína.
La instantánea evoca aquello, decimos, sólo que en el sentido contrario: de los 41 niños oncológicos que aparecen en la foto (Yago incluido), la mitad está sana y salva.
«Mi hijo me ha enseñado a pelear, como cuando no sabíamos qué hacer y me miraba con esos ojos desde la cama de la 704 y me decía que no me rindiera; me ha enseñado a ser feliz con el simple hecho de ir a recogerlo al cole o estar comiendo pipas en un banco mirándole a él».

LLEGÓ A CASA EXTRAÑADO TRAS EL SEGUNDO DÍA DE CLASE. ME PREGUNTÓ: 'MAMÁ, ¿DÓNDE ESTÁN LOS NIÑOS SIN PELO Y EN SILLA DE RUEDAS?
María Jesús Quiroga, madre de Yago
La lluvia está fría, chaval.
Las hormigas siempre van en fila, ya sabes.
Las moscas no se comen a nadie, eh.
Los niños pueden tener melena.
Y todos, sin excepción, tienen una sombra.
Por eso, al poco de incorporarse al colegio, Yago se acordó de los que cada día pelean para no quedarse sin ella.
«Llegó a casa, era el segundo día que iba a clase, se me acercó extrañado y me hizo una pregunta que no se me olvidará: 'Mamá, ¿dónde están los niños sin pelo y en silla de ruedas?'».
Lo cuenta su madre mientras mira a los hijos.
Cómo escucha el mayor.
Y cómo corre el pequeño de contento a ver centrifugar la lavadora.
https://www.elmundo.es/papel/historias/2018/12/10/5c06c86ffdddff2f6d8b45c5.html