P
pilou12
Guest
Un simple antibiótico frena en ratones un cáncer que mata a 800.000 personas al año
Un estudio asocia la presencia de una bacteria a tumores colorrectales y sus metástasis en humanos
MANUEL ANSEDE
24 NOV 2017 - 15:46 CET

Paolo Nuciforo, investigador en el Vall d’Hebron Instituto de Oncología, en Barcelona. VHIO
Concéntrese en su boca. Pase la lengua entre sus dientes y la mucosa de sus carrillos. En esos recovecos vive la Fusobacterium nucleatum, una bacteria habitual en la boca humana que se asocia a infecciones de las encías. Somos, según un manido chascarrillo científico, más microbianos que humanos: en el cuerpo de una persona normal hay 39 billones de bacterias y solo 30 billones de células humanas. Y la ciencia apenas está empezando a comprender este complejísimo mundo microscópico.
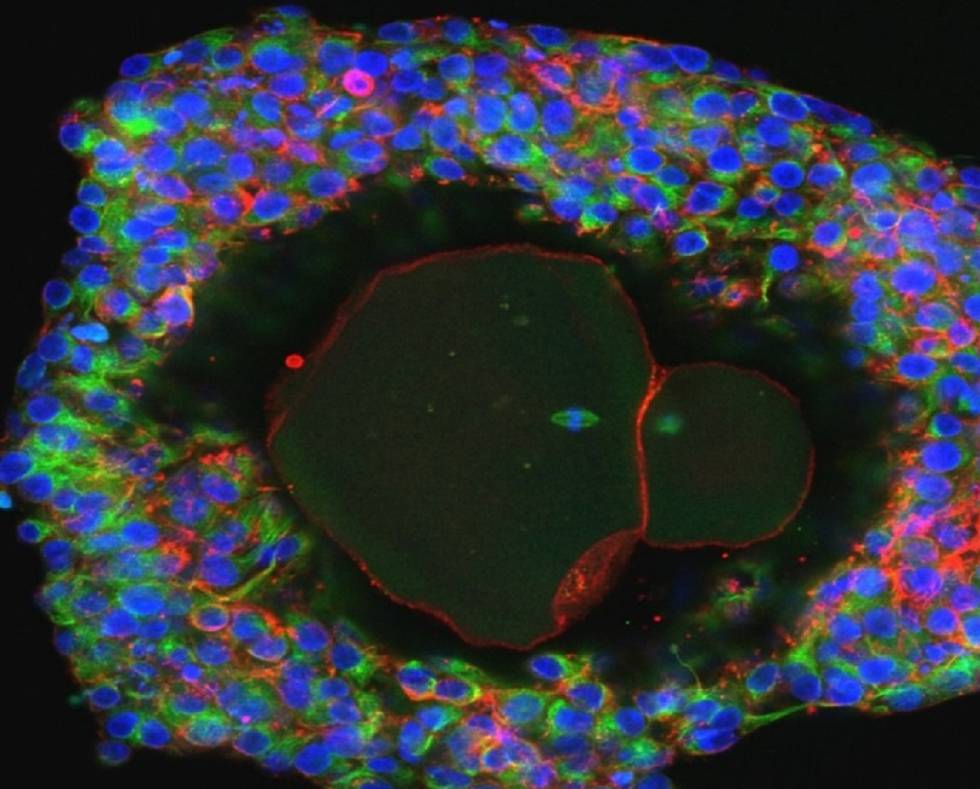
El último descubrimiento puede ser trascendental. Desde hace unos cinco años, la comunidad científica intuye el cada vez más evidente vínculo entre la Fusobacterium y el cáncer colorrectal, responsable de 775.000 muertes cada año en el mundo, 15.000 de ellas en España. La bacteria aparece habitualmente en el ecosistema microbiano de estos tumores en el intestino grueso. Y un equipo internacional de científicos acaba de descubrir que la bacteria también viaja con las células tumorales que provocan metástasis en el hígado.
“Estos datos sugieren que las bacterias, más que compañeras de viaje, pueden ser las impulsoras de estas metástasis”, sostiene Paolo Nuciforo, coautor del estudio e investigador en el Vall d’Hebron Instituto de Oncología, en Barcelona. Las bacterias, afirma, podrían provocar alteraciones moleculares que dieran lugar a tumores en las células humanas.
No es la primera vez que se asocian bacterias y cáncer. La relación entre la Helicobacter pylori y el cáncer de estómago se conoce desde 1994”, explica Nuciforo. La infección por H. pylori se considera, de hecho, la principal causa de cáncer gástrico, un tumor culpable de otras 750.000 muertes anuales en el mundo. “Ahora estamos constatando también la relación entre Fusobacterium y cáncer colorrectal”, subraya el patólogo.
El equipo de Nuciforo ha detectado Fusobacterium en el 70% de una muestra de 200 tumores colorrectales humanos. En las metástasis hepáticas de esos tumores primarios también aparecen las mismas cepas de la bacteria, dentro de las propias células tumores.
“Si no existiera una relación, sería casi imposible que la flora microbiana de un tumor en el colon fuera igual que la de un tumor en el hígado. Son órganos totalmente diferentes”, apunta el investigador. El trabajo, publicado hoy en la revista Science, está liderado por científicos del Instituto del Cáncer Dana-Farber, en Boston (EE UU).
Los autores han ido un paso más allá. Han injertado estos tumores humanos en ratones y los han tratado con un simple antibiótico, el metronidazol, empleado habitualmente en infecciones de uretra y vagina. El antibiótico por sí solo ha logrado algo insólito: frenar un 30% el crecimiento de los tumores en los ratones, según detalla Nuciforo.
“Una nueva estrategia contra los tumores colorrectales asociados a Fusobacterium sería una combinación de quimioterapia y antibióticos. Pero para confirmar esto necesitamos más ensayos clínicos”, señala el patólogo. Un primer paso sería desarrollar un antibiótico específico contra Fusobacterium, ya que el metronidazol mata también a otras bacterias de la flora intestinal. "En carcinoma gástrico ya se emplean tratamientos preventivos con antibióticos. Lo mismo podría hacerse con Fusobacterium si se confirman nuestros resultados", hipotetiza Nuciforo.
https://elpais.com/elpais/2017/11/23/ciencia/1511467905_153499.html
Un estudio asocia la presencia de una bacteria a tumores colorrectales y sus metástasis en humanos
MANUEL ANSEDE
24 NOV 2017 - 15:46 CET

Paolo Nuciforo, investigador en el Vall d’Hebron Instituto de Oncología, en Barcelona. VHIO
Concéntrese en su boca. Pase la lengua entre sus dientes y la mucosa de sus carrillos. En esos recovecos vive la Fusobacterium nucleatum, una bacteria habitual en la boca humana que se asocia a infecciones de las encías. Somos, según un manido chascarrillo científico, más microbianos que humanos: en el cuerpo de una persona normal hay 39 billones de bacterias y solo 30 billones de células humanas. Y la ciencia apenas está empezando a comprender este complejísimo mundo microscópico.
El último descubrimiento puede ser trascendental. Desde hace unos cinco años, la comunidad científica intuye el cada vez más evidente vínculo entre la Fusobacterium y el cáncer colorrectal, responsable de 775.000 muertes cada año en el mundo, 15.000 de ellas en España. La bacteria aparece habitualmente en el ecosistema microbiano de estos tumores en el intestino grueso. Y un equipo internacional de científicos acaba de descubrir que la bacteria también viaja con las células tumorales que provocan metástasis en el hígado.
“Estos datos sugieren que las bacterias, más que compañeras de viaje, pueden ser las impulsoras de estas metástasis”, sostiene Paolo Nuciforo, coautor del estudio e investigador en el Vall d’Hebron Instituto de Oncología, en Barcelona. Las bacterias, afirma, podrían provocar alteraciones moleculares que dieran lugar a tumores en las células humanas.
No es la primera vez que se asocian bacterias y cáncer. La relación entre la Helicobacter pylori y el cáncer de estómago se conoce desde 1994”, explica Nuciforo. La infección por H. pylori se considera, de hecho, la principal causa de cáncer gástrico, un tumor culpable de otras 750.000 muertes anuales en el mundo. “Ahora estamos constatando también la relación entre Fusobacterium y cáncer colorrectal”, subraya el patólogo.
El equipo de Nuciforo ha detectado Fusobacterium en el 70% de una muestra de 200 tumores colorrectales humanos. En las metástasis hepáticas de esos tumores primarios también aparecen las mismas cepas de la bacteria, dentro de las propias células tumores.
“Si no existiera una relación, sería casi imposible que la flora microbiana de un tumor en el colon fuera igual que la de un tumor en el hígado. Son órganos totalmente diferentes”, apunta el investigador. El trabajo, publicado hoy en la revista Science, está liderado por científicos del Instituto del Cáncer Dana-Farber, en Boston (EE UU).
Los autores han ido un paso más allá. Han injertado estos tumores humanos en ratones y los han tratado con un simple antibiótico, el metronidazol, empleado habitualmente en infecciones de uretra y vagina. El antibiótico por sí solo ha logrado algo insólito: frenar un 30% el crecimiento de los tumores en los ratones, según detalla Nuciforo.
“Una nueva estrategia contra los tumores colorrectales asociados a Fusobacterium sería una combinación de quimioterapia y antibióticos. Pero para confirmar esto necesitamos más ensayos clínicos”, señala el patólogo. Un primer paso sería desarrollar un antibiótico específico contra Fusobacterium, ya que el metronidazol mata también a otras bacterias de la flora intestinal. "En carcinoma gástrico ya se emplean tratamientos preventivos con antibióticos. Lo mismo podría hacerse con Fusobacterium si se confirman nuestros resultados", hipotetiza Nuciforo.
https://elpais.com/elpais/2017/11/23/ciencia/1511467905_153499.html